Rápido despliegue de nuevas vacunas contra de COVID sin ensayos en humanos: «una historia de imprudencia»
 Por Meryl Nass.- El lanzamiento más rápido de una nueva vacuna en la historia mundial ocurrió de la única manera en que podría ocurrir: doblando las reglas, creando un nuevo libro de jugadas regulatorias y no obteniendo ningún dato humano para las nuevas vacunas.
Por Meryl Nass.- El lanzamiento más rápido de una nueva vacuna en la historia mundial ocurrió de la única manera en que podría ocurrir: doblando las reglas, creando un nuevo libro de jugadas regulatorias y no obteniendo ningún dato humano para las nuevas vacunas.
El 31 de agosto, la FDA emitió EUA para las nuevas vacunas de refuerzo de ARNm de Pfizer y Moderna para COVID-19.
Un día después, los CDC y su directora, la doctora Rochelle Walensky, aprobaron el lanzamiento inmediato de las nuevas vacunas, que se administrarán en Estados Unidos a partir de esta semana.
Sorprendentemente, más de un mes antes de que cualquiera de las agencias hubiera dado su visto bueno a la formulación completamente nueva, el gobierno federal ordenó 105 millones de dosis a Pfizer y 66 millones de dosis a Moderna.
La composición deseada de la vacuna solo había sido determinada formalmente por la FDA después de que su comité asesor se reuniera el 24 de junio.
Las vacunas contienen una mezcla del antiguo ARNm original de la vacuna de la cepa de Wuhan (ahora también conocida como la vacuna ancestral) y un nuevo ARNm Omicron BA.4/5 que codifica para la proteína espiga de Omicron.
La cantidad total de ARNm para las vacunas de refuerzo de Pfizer y Moderna es la misma que antes: 30 mcg para Pfizer y 50 mcg para Moderna. Cada uno está compuesto por un 50% de ARNm de Omicron y un 50% de ARNm ancestral, por lo que se denominan vacunas bivalentes.
Los nuevos viales y sus cajas no enumeran la dosis, lo que sugiere que la decisión sobre cuánto usar se tomó hace muy poco. Incluso los miembros del comité asesor de los CDC no sabían la dosis de las nuevas vacunas bivalentes hasta su reunión del 1 de septiembre.
Este es el lanzamiento más rápido de una nueva vacuna en la historia mundial. Y en lugar de ser una historia de determinación e ingenio humanos, es una historia de debilidad e imprudencia humana.
¿Cómo se produjo un despliegue tan rápido de la vacuna?
Ocurrió de la única manera en que podría ocurrir: doblando las reglas, creando un nuevo libro de jugadas regulatorias y no obteniendo ningún dato humano para las nuevas vacunas.
Los fabricantes no tuvieron que pasar por ensayos de meses de duración, y la FDA no tuvo que estudiar detenidamente ningún dato de ensayo en humanos, porque no había ninguno.
Dejemos que eso se hunda: Las nuevas vacunas bivalentes BA.4/5 se probaron solo en ratones, no en humanos.
Coordinación internacional inesperada
Aquí hay un hecho sorprendente: el 1 de septiembre, el mismo día en que los CDC aprobaron el programa de vacunas, las agencias de salud en Canadá, Suiza y la Asociación Europea de Medicamentos (el equivalente de la UE a la FDA) también lanzaron nuevos programas de vacunas de refuerzo bivalentes.
Casi simultáneamente, el Reino Unido autorizó dos refuerzos bivalentes diferentes, el 15 de agosto y el 3 de septiembre.
El Reino Unido le dijo a la gente que esperara el mayor despliegue en la historia para los nuevos refuerzos bivalentes, y comenzó el programa prometiendo grandes bonificaciones a los médicos si logran vacunar a todos los residentes de un hogar de ancianos para el 23 de octubre.
Estos otros países están utilizando un ARNm anterior de Omicron como plantilla para sus vacunas bivalentes ancestrales de Omicron, mientras que Estados Unidos está utilizando el código de ARNm para la variante posterior de Omicron BA.4/5.
Los principales medios de comunicación eluden las preguntas clave
¿Cómo están contando esta historia los principales medios de comunicación? Con su giro habitual, evitando las partes pegajosas.
En lugar de ayudarte a entender lo que acaba de suceder, The New York Times pregunta: «¿Cuándo deberías conseguir el tuyo?» No debe obtenerlo, solo cuándo debe obtenerlo.
El Herald Tribune te dice por qué deberías conseguirlo. STAT News dice que responde a sus preguntas, pero nunca hace las preguntas relevantes sobre por qué ocurrió un despliegue tan rápido y sin precedentes, especialmente cuando estamos en mínimos prácticamente históricos de muertes y estadías en la UCI debido a COVID-19.
The Associated Press lo hizo un poco mejor, al menos planteando la pregunta de si debería obtener un nuevo refuerzo, pero luego sus respuestas no profundizan más que sus compañeros de medios.
Parece que no obtendrá la información que necesita para comprender los impulsores y el proceso por el cual fueron introducidos por los principales medios de comunicación.
Así que The Defender revisó los documentos de la FDA, asistió a la reunión del comité asesor de los CDC durante todo el día el 1 de septiembre, estudió una revisión de los refuerzos publicados el 31 de agosto en el New England Journal of Medicine (NEJM) y evaluó un estudio de refuerzos de Omicron que fueron probados en primates no humanos por el Centro de Investigación de Vacunas del Dr. Anthony Fauci.
La FDA hace girar la narrativa «segura y efectiva» a pesar de la falta de datos de apoyo
La FDA no convocó a su comité asesor antes de emitir las autorizaciones, no es difícil adivinar por qué.
El año pasado, los asesores de la FDA votaron en contra de autorizar los refuerzos ancestrales porque los datos que se les dieron indicaban que las vacunas antiguas estaban funcionando bien.
Dos altos funcionarios de la FDA que no estaban de acuerdo con el lanzamiento del refuerzo de 2021 renunciaron, insinuando que la decisión de emitir refuerzos se había impuesto a la FDA.
Este año, los miembros del Comité Asesor de Vacunas y Productos Biológicos Relacionados (VRBPAC) de la FDA se han quejado de que se les dan cada vez menos datos a medida que se les pide que aprueben los programas de vacunas para edades cada vez más jóvenes.
El miembro de VRBPAC, el Dr. Paul Offit, profesor de enfermedades infecciosas pediátricas en la Universidad de Pensilvania y coinventor de una vacuna contra el rotavirus, dijo el mes pasado: «La solución estaba en marcha», lo que implica que las deliberaciones del comité fueron una farsa y señaló que la Casa Blanca anunció que estaba comprando la vacuna justo después de que terminara la reunión.
Offit dijo la semana pasada que los datos del mouse no eran suficientes para lanzar los nuevos impulsores. Así que la FDA decidió no darle a él y a los otros miembros un lugar público donde previsiblemente se quejarían de la laxitud de la FDA, lo que algunos podrían llamar imprudencia, insubordinación o incluso malversación grave.
Después de todo, de acuerdo con la declaración de misión de la FDA, la FDA «es responsable de proteger la salud pública al garantizar la seguridad, la eficacia y la seguridad de los medicamentos humanos y veterinarios, los productos biológicos y los dispositivos médicos», no sellar las vacunas no probadas.
La FDA justificó sus autorizaciones utilizando un lenguaje que probablemente tenía la intención de confundir al público.
Por ejemplo, todo el mundo conoce el término «seguro y eficaz», que es un sello oficial de aprobación de la FDA para medicamentos y vacunas con licencia.
Sin embargo, por ley, el término no puede ser utilizado por la FDA para referirse a productos experimentales sin licencia, que es lo que son todos los medicamentos y vacunas de la EUA.
Entonces, en un comunicado de prensa sobre los nuevos refuerzos, la FDA utilizó una terminología casi idéntica, pero no idéntica, citando al Dr. Peter Marks, director del centro de vacunas de la FDA: «Hemos trabajado estrechamente con los fabricantes de vacunas para garantizar que el desarrollo de estos refuerzos actualizados se realice de manera segura y eficiente».
Marks también dijo: «El público puede estar seguro de que la FDA ha tenido mucho cuidado para garantizar que estas vacunas bivalentes COVID-19 cumplan con nuestros rigurosos estándares de seguridad, efectividad y calidad de fabricación para la autorización de uso de emergencia».
Una vez más, «seguro y efectivo» está implícito, pero no se indica exactamente.
Lo que Marks espera que el público pase por alto es el hecho de que no existen estándares de calidad para las EUA. El estatuto que autoriza las EUA simplemente requiere que los beneficios conocidos y esperados superen los riesgos conocidos y esperados del producto.
La FDA ni siquiera está obligada a inspeccionar las fábricas donde se fabrican los productos EUA, como debe hacer para los productos con licencia. Tampoco está obligado a inspeccionar el producto final.
Marks y la FDA saben que a todos los productos de eua se les ha otorgado una exención de responsabilidad extremadamente amplia que cubre a Marks, la FDA, los CDC, el Departamento de Salud y Servicios Humanos de los Estados Unidos, los fabricantes y distribuidores de vacunas, médicos, farmacéuticos y todos los involucrados en el programa de vacunas.
Así que pueden decirnos cualquier cosa porque el público no tiene recurso a los tribunales para presentar una demanda cuando se trata de un producto EUA.
La FDA justificó su evaluación de que las vacunas no probadas son seguras utilizando el siguiente argumento: «Los datos de seguridad acumulados con la vacuna bivalente (original y Omicron BA.1) y con la vacuna monovalente Moderna COVID-19 son relevantes para la vacuna Moderna COVID-19, bivalente porque estas vacunas se fabrican utilizando el mismo proceso».
Esto es lo mismo que afirmar que la mantequilla de almendras es segura, por lo que la mantequilla de maní también es segura, porque se fabrica utilizando el mismo proceso.
¿Es esa realmente la mejor excusa para no realizar las funciones regulatorias que la FDA puede ofrecer?
Los CDC sabían que tendría dificultades para convencer al público de que tomara estas vacunas, ya que casi todos ya han tenido COVID-19, los beneficios anteriores de la vacuna fueron demasiado prometedores, la enfermedad se ha vuelto más leve, las vacunas no previenen la infección o la transmisión y el temor en torno a COVID-19 ha desaparecido en su mayoría.
Así que la agencia tuvo que idear nuevas estrategias. Uno de ellos fue invocar el «efecto carro», que significa tratar de convencer al público de que todos los demás están recibiendo la inyección, por lo que deberían subirse al carro.
Una encuesta que afirma que el 72% de los elegibles planeaban obtener los nuevos refuerzos se presentó en la reunión del Comité Asesor sobre Prácticas de Inmunización (ACIP) de los CDC. Pero, ¿qué tan probable es que eso sea cierto?
Solo el 33% de la población ha tenido un primer refuerzo, mientras que el 65% ha dicho: «No, gracias». Y el interés en los pinchazos de COVID-19 ha disminuido: menos del 5% de los niños en edad preescolar han recibido una vacuna contra covid-19 en los tres meses desde que fueron autorizados.
Los CDC insinuaron al ACIP que el 49% del público había sido impulsado, mientras que sus propias estadísticas, según The New York Times, dicen que el número real es del 33%.
Así es como los CDC realizaron el cálculo para que parezca que los refuerzos son más populares de lo que son: el 67% del público está «completamente vacunado», según los CDC. Cuarenta y nueve por ciento de los 67% (que están completamente vacunados) equivale al 33%.
El gobierno federal asignó $ 1 mil millones para comprar publicidad y garantizar una cobertura de noticias positivas (y suprimir las malas noticias) para impulsar las vacunas anteriores contra el COVID-19. Uno se pregunta cuánto se gastará para impulsar los nuevos impulsores.
Según los CDC, 224 millones de estadounidenses están «completamente vacunados». A los miembros del ACIP se les dijo que de este número, 210 millones ya son elegibles para los nuevos refuerzos.
El gobierno ha comprado 171 millones de dosis de refuerzo bivalente hasta ahora (105 millones de Pfizer y 66 millones de Moderna) que se pueden usar para las personas de 12 años en adelante.
La FDA y los CDC aún no han permitido el lanzamiento de nuevos refuerzos bivalentes para niños menores de 12 años, que en el pasado recibieron vacunas COVID-19 de dosis más bajas. Pero las agencias dijeron que planean hacerlo en cuestión de semanas.
¿Cuánto tiempo funcionará?
Otro tema difícil para el comité ACIP fue la cuestión de cuánto tiempo funcionarán estos refuerzos y con qué frecuencia se recomendarán.
Los miembros del ACIP son responsables de dar consejos sobre todas las vacunas, y no quieren que las vacunas COVID-19 agrien al público con otras vacunas.
Aunque una recomendación de administrar los refuerzos bivalentes cuatro meses después de una dosis anterior se había planteado una vez, se le pidió al comité ACIP que aprobara los refuerzos cuando hubieran pasado al menos dos meses desde una dosis anterior.
Evelyn Twentyman, de los CDC, dijo que los CDC ya no cuentan el número total de dosis.
Dijo que incluso si una persona ha recibido cuatro o cinco vacunas previas contra el COVID-19, no se debe negar un nuevo refuerzo bivalente, siempre y cuando hayan pasado dos meses desde la última dosis.
Según el NEJM:
Se ha demostrado que el aumento de los títulos de anticuerpos neutralizantes, así como la efectividad clínica, disminuyen cuatro meses después de una tercera inmunización de ARN mensajero. Después de una cuarta inmunización de ARN mensajero, se ha informado que la protección contra la infección con SARS-CoV-2 Omicron disminuye después de solo 4 semanas, aunque la protección contra la enfermedad grave dura más tiempo.
La inmunidad híbrida tanto de la vacunación como de la infección proporciona una protección mayor y más duradera que cualquiera de las dos solas.
¡Cuatro semanas! Los títulos de anticuerpos se hunden cuatro semanas después de la cuarta dosis, no es de extrañar que los CDC estén permitiendo, y puedan alentar, tales refuerzos frecuentes.
Los vacunadores contra el COVID-19 han acuñado un nuevo término, inmunidad híbrida, que elimina los coches eléctricos híbridos. Se refiere a la inmunidad mejorada que tiene una persona vacunada si también contrajo la enfermedad, como si estuviera vacunada pero contrayendo la enfermedad de todos modos se normalizara como deseable.
Después de que los CDC pasaron dos años negando que la inmunidad natural, el tipo de inmunidad que las personas obtienen después de la infección, incluso exista, la agencia ahora está tratando de tomar una vacuna de limón, agregar inmunidad natural, llamarla inmunidad híbrida y hacer limonada.
¿Cómo se justificó este despliegue?
Las variantes de Omicron han estado presentes desde noviembre pasado, y pronto se descubrió que tanto la inmunidad inducida por la vacuna como la natural debido a las variantes anteriores eran muy limitadas para las variantes de Omicron, porque son muy diferentes de la cepa ancestral.
Las agencias de salud y los fabricantes han estado probando prototipos de vacunas Omicron durante hasta nueve meses. La mayoría de esas pruebas involucraron cepas BA.1 y BA.2 Omicron.
Sin embargo, el 90% de los casos actuales son causados por Omicron BA.5, que está genéticamente lejos de BA.1 y BA.2.
Pero había algunos datos humanos (que involucraban a unos pocos cientos de sujetos cada uno) para varios de los prototipos anteriores de la vacuna Omicron, por lo que las agencias de salud decidieron simplemente fingir que el ARNm diseñado para BA.1 y BA.2 estaba lo suficientemente cerca de BA.5 como para que los datos fueran comparables.
Dado que el 50% del contenido de la vacuna sería la vacuna anterior, la FDA afirmó que ya había establecido la seguridad y eficacia de esa mitad.
Luego, para redondear las cosas, hubo datos de ratones, que generaron niveles de anticuerpos comparables a las nuevas vacunas como lo habían hecho con las vacunas más antiguas. Y, por supuesto, podemos confiar en que los ratones se comporten exactamente como las personas, ¿verdad? Después de todo, han sido «humanizados» para contener un receptor HUMANO ACE-2.
No, no podemos confiar en los ratones. Ni siquiera podemos confiar en los primates no humanos como modelo para las vacunas, ya que cada especie reacciona de manera única e impredecible a las infecciones y a las vacunas.
Pero los datos de ratones aumentan el «paquete» de autorización de la FDA, por lo que parece que la agencia hizo una revisión más exhaustiva.
Los nuevos refuerzos no son una mejora con respecto a las vacunas antiguas
Las predicciones de la revista Nature y el Centro de Investigación de Vacunas de Fauci en los Institutos Nacionales de Salud son que las nuevas vacunas no mejorarán las vacunas antiguas.
Según el Centro de Investigación de Vacunas, «Un estudio en primates no humanos mostró que una vacuna de ARN mensajero específico de Omicron no era mejor que la vacuna original de ARN mensajero-1273 [ancestral Moderna] para la protección contra el desafío de Omicron».
Nature señaló: «Un análisis sugiere que los refuerzos actualizados parecen ofrecer la misma protección que una dosis adicional de las vacunas más antiguas, particularmente cuando se trata de mantener a las personas fuera del hospital».
Ninguno de estos estudios se discutió en la reunión del ACIP. No se proporcionó ninguna discusión sobre por qué y cómo se eligieron las vacunas bivalentes.
Según el Centro de Investigación de Vacunas, las vacunas Omicron no estimularán una buena respuesta de Omicron debido al cebado antigénico, también conocido como pecado antigénico original.
Esto significa que el sistema inmunológico ha sido programado para responder una y otra vez a la primera infección por coronavirus o vacuna que encontró, incluso cuando se encuentra con diferentes antígenos de coronavirus más tarde.
¿Cómo funcionó la vieja vacuna?
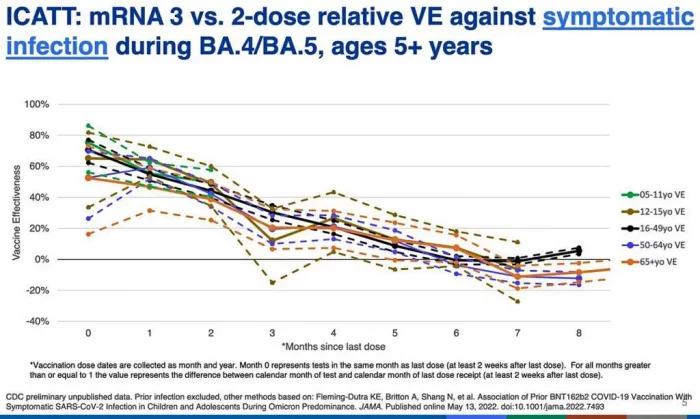 La diapositiva de los CDC a continuación, presentada por la Dra. Ruth Link-Gelles de los CDC, no está bien etiquetada, pero muestra que si recibió dos o tres dosis de la vacuna anterior, durante el período Omicron la eficacia en todos los grupos de edad fue inferior al 40% a los tres meses.
La diapositiva de los CDC a continuación, presentada por la Dra. Ruth Link-Gelles de los CDC, no está bien etiquetada, pero muestra que si recibió dos o tres dosis de la vacuna anterior, durante el período Omicron la eficacia en todos los grupos de edad fue inferior al 40% a los tres meses.
A los seis meses rondaba la eficacia cero (sin beneficio), y después de eso fue negativo (dañino) para la mayoría de las edades.
La eficacia negativa significa que los vacunados son más propensos a infectarse con COVID-19 que los no vacunados.
Esto es consistente con lo que estamos viendo en el Reino Unido y algunos otros países: los vacunados tienen más probabilidades de contraer COVID-19.
Y es este efecto el que las agencias de salud pública probablemente están tratando de evitar, o esconder, con refuerzos perpetuos.
Parece que el público aquí y en muchos otros países está siendo engañado para recibir una vacuna no probada (o en otros países una inyección BA.1 o .2 mínimamente probada) con la falsa promesa de que será mucho mejor que la vacuna anterior.
Los reguladores saben que es poco probable que sea mejor, pero sus motores de relaciones públicas se aceleran para convencernos de lo contrario.
¿Son seguras las nuevas vacunas?
Qué tan seguros son los nuevos impulsores es una incógnita, porque no se puede evaluar la seguridad humana a partir de modelos animales, ya que no predicen la respuesta humana.
Entonces, ¿qué se hizo para evaluar la seguridad de las vacunas bivalentes?
Reactogenicidad: Reactogenicidad es una palabra que se refiere a reacciones adversas a la vacuna a corto plazo, como fiebre, enrojecimiento, fatiga o dolores musculares.
Según los informantes de los CDC, el grado de reactogenicidad de las vacunas prototipo de Omicron fue comparable al de las vacunas COVID-19 «ancestrales» más antiguas.
No había datos sobre efectos secundarios más graves, y el Dr. Tom Shimabukuro de los CDC dijo que no había forma de evaluar el riesgo de miocarditis debido al pequeño número de sujetos que recibieron las vacunas prototipo.
Sin embargo, si observa la tabla de Pfizer a continuación, preparada para los miembros del ACIP, notará que hubo una mayor reactogenicidad (efectos secundarios más agudos) observada después de las vacunas prototipo de Omicron que después de las vacunas más antiguas.
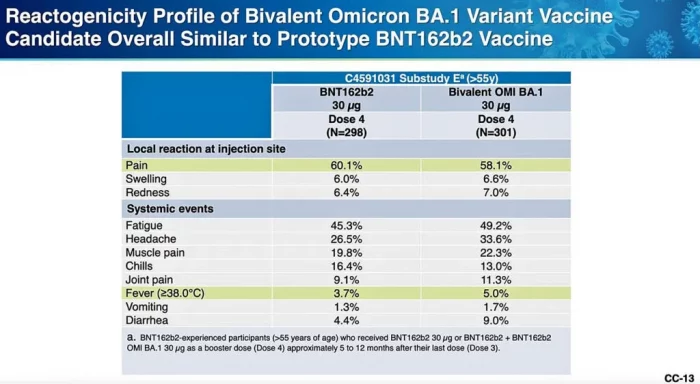 Esto puede ser una señal de que las reacciones más graves resultarán de las vacunas más nuevas, pero no hay forma de estar seguro.
Esto puede ser una señal de que las reacciones más graves resultarán de las vacunas más nuevas, pero no hay forma de estar seguro.
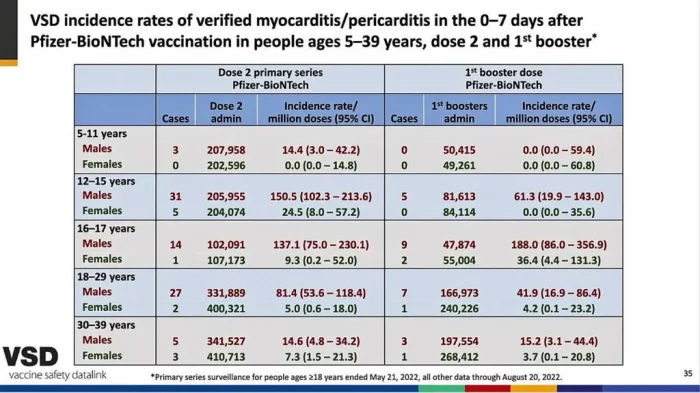
Miocarditis: Los presentadores del ACIP afirmaron que la miocarditis era menos común después de las vacunas de refuerzo de la vacuna anterior que después de la segunda dosis de la serie inicial.
Sin embargo, la diapositiva 39 (abajo), mostrada por Shimabukuro pero rápidamente pasada por alto, mostró lo contrario.
Para los niños y niñas de 16 a 17 años, y para los hombres de 30 a 39 años, la probabilidad de miocarditis aumentó después de un refuerzo.
Por lo tanto, no hay razón para pensar que los refuerzos serán más seguros que la segunda dosis, en términos de miocarditis. Ese riesgo, por cierto, fue de aproximadamente 1 en 2,000 hombres jóvenes de 18 a 24 años después de su segunda dosis en un estudio de Kaiser.
 Shimabukuro también dijo que si se vacuna poco después de recuperarse de COVID-19, se esperan mayores efectos secundarios, al menos a corto plazo, pero «hay una falta de evidencia de que lo coloque en mayor riesgo de miocarditis».
Shimabukuro también dijo que si se vacuna poco después de recuperarse de COVID-19, se esperan mayores efectos secundarios, al menos a corto plazo, pero «hay una falta de evidencia de que lo coloque en mayor riesgo de miocarditis».
No me tranquiliza la falta de pruebas. De hecho, el cardiólogo pediátrico Dr. Kirk Milhoan revisó la semana pasada toda la evidencia que Shimabukuro no pudo encontrar.
Vacunarse poco después de recuperarse de COVID-19 es temerario, y cualquier funcionario que ordene las vacunas después de la recuperación está poniendo a las personas en un riesgo aún mayor de reacciones adversas, incluida la miocarditis.
Algunos científicos, incluido Dan Barouch, MD, Ph.D., afirman que la miocarditis es «mucho más frecuente» después de un caso de COVID-19 que después de la vacunación. Pero no citó ni una sola fuente para esta afirmación.
El Dr. Kirk Milhoan, cardiólogo pediátrico, revisó toda la literatura reciente sobre la cuestión de las tasas de miocarditis después de la infección versus después de la vacunación. Parece que la vacuna lo pone en mayor riesgo de miocarditis que una infección por COVID-19, pero hay muchos factores diferentes que influyen en el riesgo, incluida la edad, el sexo, si ya tuvo COVID-19 y qué tan recientemente y el tipo de vacunas recibidas.
Las vacunas de Moderna tienen más probabilidades de causar miocarditis que las de Pfizer. Recibir una vacuna de Moderna después de una vacuna inicial de Pfizer aumenta el riesgo aún más que recibir dos vacunas de Moderna. (Ver Tabla 2 de un importante estudio de miocarditis en cuatro países nórdicos).
Francia, Alemania, Suecia, Noruega, Finlandia, Dinamarca e Islandia han suspendido las vacunas contra la COVID-19 de Moderna para hombres jóvenes.
Un miembro del ACIP preguntó si la vacuna contra la viruela del mono de Jynneos, que también puede inducir miocarditis, podría administrarse junto con las nuevas vacunas bivalentes. ¿Aumentaría esto el riesgo de miocarditis?
La respuesta sorprendente fue: «Lea el libro informativo», lo que puede haber significado que esto no se iba a discutir en público.
¿Deben las mujeres embarazadas recibir los nuevos refuerzos?
Hablando de lo que podría discutirse en público, cualquier discusión sobre el embarazo y la vacunación contra el COVID-19 estaba prohibida en la reunión del ACIP. Varios miembros del comité pidieron información sobre el embarazo, pero los informantes se negaron rotundamente a proporcionar ninguna. Nada sobre hospitalizaciones, muertes, resultados fetales.
A los miembros del ACIP se les dijo que serían informados sobre esto en una reunión futura. Moderna dijo que la compañía estaba en el proceso de inscribir a un total de 800 mujeres embarazadas en un estudio, que algún día se completaría.
Sin embargo, los CDC establecieron un registro de embarazo para las vacunas COVID-19 hace casi 18 meses.
Los CDC y la FDA deben tener datos sobre muchos miles de embarazos. Cada mujer que recibe una dosis de vacuna COVID-19 debe proporcionar información sobre si está embarazada antes de poder vacunarse y los CDC recopilan toda esta información.
Además, hay miles de informes del Sistema de Notificación de Eventos Adversos de Vacunas, o VAERS, sobre los resultados adversos del embarazo.
La FDA requirió que Pfizer-BioNTech estudiara el efecto de la vacuna en el embarazo cuando emitió una licencia para Comirnaty el 23 de agosto de 2021.
Al mismo tiempo, la FDA también requirió estudios adicionales de seguridad de vacunas en niños y estudios adicionales sobre la miocarditis. Pero estos estudios no se completarán hasta por cinco años, mucho después de que se hayan administrado miles de millones de dosis y las vacunas estén desactualizadas.
Es difícil justificar por qué la FDA pediría que estos estudios tomaran tanto tiempo. ¿Estaba la agencia solicitando duraciones de estudio tan largas para retrasar su evaluación de la seguridad de la vacuna hasta después de que las vacunas ya no estén en uso?
La única conclusión que puedo sacar es que a la FDA y los CDC no les gustan los resultados de seguridad que ya tienen, y planean retener las malas noticias durante el mayor tiempo posible.
La ‘mamá’ de los CDC sobre el COVID prolongado
El comité también estaba interesado en el COVID largo. ¿Podrían las vacunas prevenir esta terrible complicación? El CDC no estaba de acuerdo.
El informante de los CDC afirmó que los CDC no tienen «datos sistemáticos» sobre COVID largo. Los CDC tampoco han desarrollado una definición de caso para COVID largo.
¿Por qué los CDC han retrasado la investigación de esta complicación de importancia crítica?
El New York Times reveló en febrero de 2022 que los CDC ocultan la mayor parte de los datos de salud pública que recopilan. Según el Times, «Gran parte de la información retenida podría ayudar a los funcionarios de salud estatales y locales a orientar mejor sus esfuerzos para controlar el virus».
No va a encontrar una acusación más pública de nuestros CDC por parte del Times que esa.
¿La vacunación no previene el COVD prolongado? ¿Causa COVID largo?
El Dr. Paul Marik, médico de cuidados intensivos y fundador de Front Line COVID-19 Critical Care Alliance, postuló que tanto el COVID largo como muchas lesiones por la vacuna COVID-19 se deben a lo mismo: la presencia prolongada de proteínas espiga en la circulación.
Si es cierto, puede haber una superposición considerable entre los síntomas y la patología de covid largo y las lesiones por vacunas, y los CDC pueden estar tratando de ocultar esto, o tal vez estar buscando una manera de afirmar que todas las lesiones de la vacuna se deben a COVID-19.
La FDA revocó todos los EUA de Pfizer y Moderna para los antiguos impulsores el 3 de agosto.
Esto fue repentino e inesperado. Las citas tuvieron que ser canceladas, porque a partir de esa fecha, las vacunas antiguas se limitaron a usar solo en niños pequeños o para la serie inicial.
La FDA no retiró ni retiró las vacunas autorizadas Comirnaty y Spikevax, que también fueron aprobadas como dosis de refuerzo. ¿Es esto un reconocimiento tácito de que no hay Comirnaty o Spikevax con licencia disponible en los Estados Unidos?
¿Podría la FDA haber lanzado las nuevas vacunas tan rápidamente para justificar la eliminación de la mayoría de las vacunas antiguas del uso, poco después de que comenzaran a circular informes sobre su contenido que contenía materiales no revelados y posiblemente dañinos?











